
I) Aspects écologiques :
1) L’eau sur Terre :
L’eau est le principal constituant de la matière vivante (65 à 70 % du poids de l’homme), elle participe à tous les échanges vitaux et de ce fait est un transporteur de matières indispensables à la vie ( plasma, sang). C’est aussi un incroyable accumulateur. En effet les océans qui couvrent les ¾ de la surface terrestre jouent le rôle de grands régulateurs des climats et des gaz présents dans l’atmosphère.
La répartition de l’eau sur terre est inégale.
Ainsi les océans représentent 97,3% du volume :
- les glaciers et calottes polaires2,04% du volume
- les eaux souterraines 0,61%
-les lacs 0,009%
- l’humidité du sol 0,005%
- l’humidité atmosphérique 0,001%
-les rivières 0,0001%
L’eau douce utilisable représente un pourcentage infime.
A titre d’exemple : pour 4 litres d’eau, l’eau douce correspond à 100cm3, l’eau douce et liquide 25 cm3 et l’eau directement utilisable 1 goutte.
2)Le cycle de l’eau :
Sous l’action du vent et de la chaleur, les océans et les cours d’eau s’évaporent donnant naissance aux nuages et à l’humidité atmosphérique.
Ces nuages vont sous l’effet des différences de températures donner naissance à la pluie, qui s’infiltrera dans le sol pour former des rivières, donner de l’humidité au sous-sol et être absorbée par les êtres vivants qui l’excréteront, avant de retourner dans les océans.
II) Aspects chimiques :
1) Les éléments et caractéristiques :
L’eau en tant que solvant universel contient des éléments minéraux qui lui donnent des caractéristiques bien précises.
L’eau douce :
Essentiellement composée de Calcium, de Magnésium et de Carbone
sous forme d’hydrogénate de Calcium [Ca (HCO3)2]
de sulfate de Calcium Ca SO4
ensuite viennent les éléments tels que le Sodium, le Phosphore, le Potassium, le Fer 100 à 400 µg/l
L’eau de mer :
De nature plus complexe, sa teneur en sel s’échelonne en moyenne de 30 à 35 g/l
Sa composition globale est plus stable comparativement à l’eau douce, pour laquelle les paramètres sont fortement influencés par la nature des terrains dans lesquels elle prend sa source. EAU + ou - douce.
L’eau de mer est composée principalement de sel : chlorure de sodium , de magnésium, de calcium et de potassium, de souffre.
|
éléments
|
symbole
|
concentration (mg/l)
|
commentaires
|
|
CHLORE
|
CL
|
18880
|
|
|
SODIUM
|
Na
|
10770
|
|
|
MAGNESIUM
|
Mg
|
1290
|
|
|
SOUFRE
|
S
|
884
|
|
|
CALCIAM
|
Ca
|
412
|
|
|
POTASSIUM
|
K
|
399
|
|
|
BROME
|
B
|
67
|
|
|
CARBONE
|
C
|
28
|
Sous forme de HCO3,CO3,CO2
|
|
AZOTE
|
N
|
15
|
Sous forme de NH4+NO2+NO3+N2
|
|
STRONTIUM
|
Sr
|
7.9
|
|
|
BORE
|
B
|
4.5
|
|
|
SILICIUM
|
Si
|
2
|
|
|
FLUOR
|
F
|
1.3
|
Ces éléments dissous vont donner à l’eau des aspects chimiques variables, pour les quantifier plusieurs indicateurs sont à notre disposition.
Le TH :
permet de définir la quantité en sels de Calcium et de Magnésium.
C.A.D.: les Sulfates
les Nitrates de Calcium et de Magnésium
les Bicarbonates
C’est la dureté totale de l’eau.
*Elle varie pour l’eau douce :
- à des valeurs très basses : 0° à 4° (eau douce Amazonie).
- à des valeurs très élevées : 25° (eau dure des lacs africains).
*En eau de mer :
Ce n’est pas significatif sa valeur est >300 .
Le T.A.C. :
C’est la quantité de bicarbonate,Carbonate et Hydrate présente dans l’eau.
L’élément le plus commun est le bicarbonate HCO3-, qui s’associe avec les éléments
Ca - Mg - Na - K-(calcium- magnésium- sodium- potassium).
En eau douce :
Suivant les éléments avec lesquels il est associé, le T.A.C. sera >TH ou <TH

le tableau nous montre les éléments en jeu. La situation T.A.C.>TH est spécifique aux grands lacs africains.
Sa valeur pour : l’eau douce varie de 3 à 12
: l’eau de mer est 13, il est associé principalement à Ca , Mg , Na
C’est le T.A.C. qui va " tamponner "(éviter la variation de PH de l’eau)
Le PH :
Indique la concentration de l’eau en ions H3O+
(ions acides) et ions OH- (ions basiques) suivant la réaction 2H2O H3O+ +OH-
En pratique PH = - log10[H30+] pour PH = 7
[ H30+] = 10 puissance -7
[OH-] = 10 puissance -7
Si le PH est > 7 alors il est basique
PH est = 7 alors il est neutre
PH est < 7 alors il est acide
Comparativement la concentration évolue très rapidement pour une augmentation du PH : suivant le tableau :
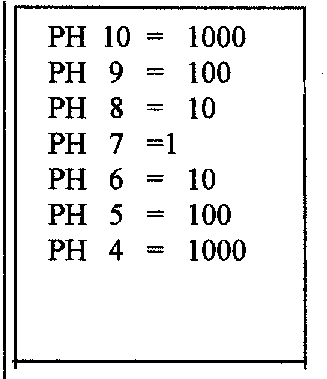 le PH 9 est 100 x plus
basique que le PH 7
le PH 9 est 100 x plus
basique que le PH 7
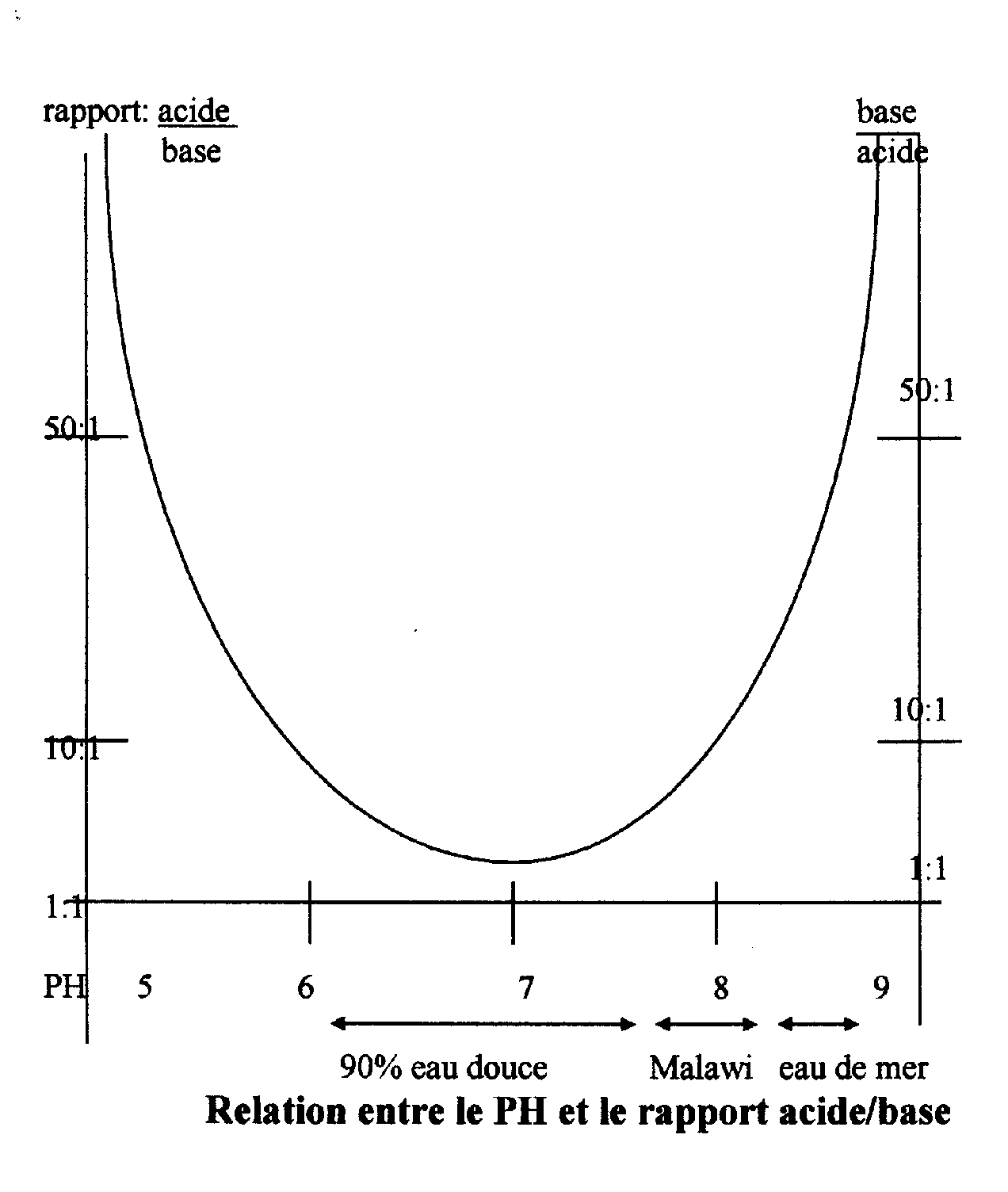
Les variations de PH sont donc à minimiser dans le milieu fermé de l’aquarium.
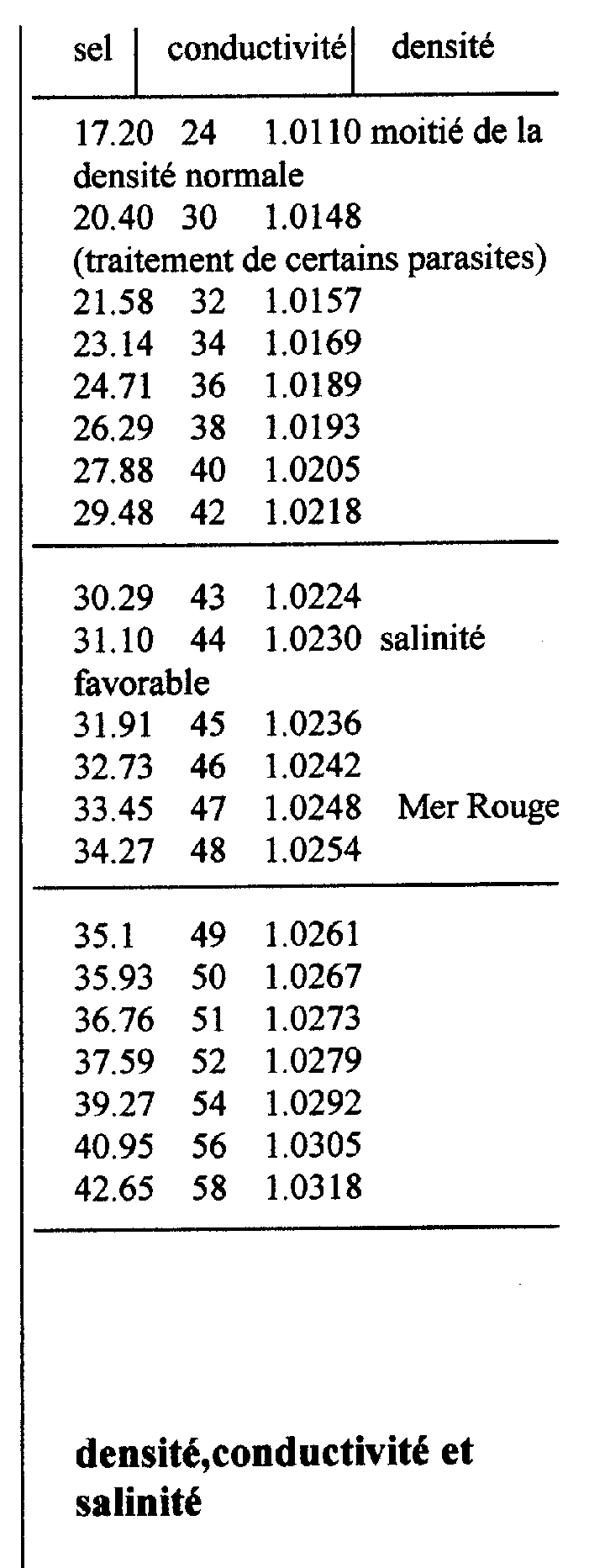
La salinité
Eau de mer : c’est la concentration (en sel) totale dans l’eau. On la mesure à l’aide d’un hydromètre ou à partir de la conductivité (pouvoir de laisser passer le courant électrique).
2) Les gaz dissous :
L’oxygène : O2:
Eléments de respiration de tous les êtres vivants, sa concentration dans l’eau doit toujours être optimale.
La concentration en éléments d’une eau détermine son pouvoir de dissolution ainsi plus l’eau est salée moins elle dissout l’oxygène.
En pratique :
*L’eau douce contient 8,26 mg/l d’oxygène pour une température de 25°C et une pression de 1 Atmosphère (1013 mbars) (niveau de la mer).
*L’eau de mer contient 6,8mg/l pour 25°C et de 1 Atmosphère de pression.

L’oxygène dissous conditionne le potentiel Redox c’est-à-dire son pouvoir d’oxydation. Ce pouvoir d’oxydation influence directement les réactions chimiques opérant dans l’aquarium.

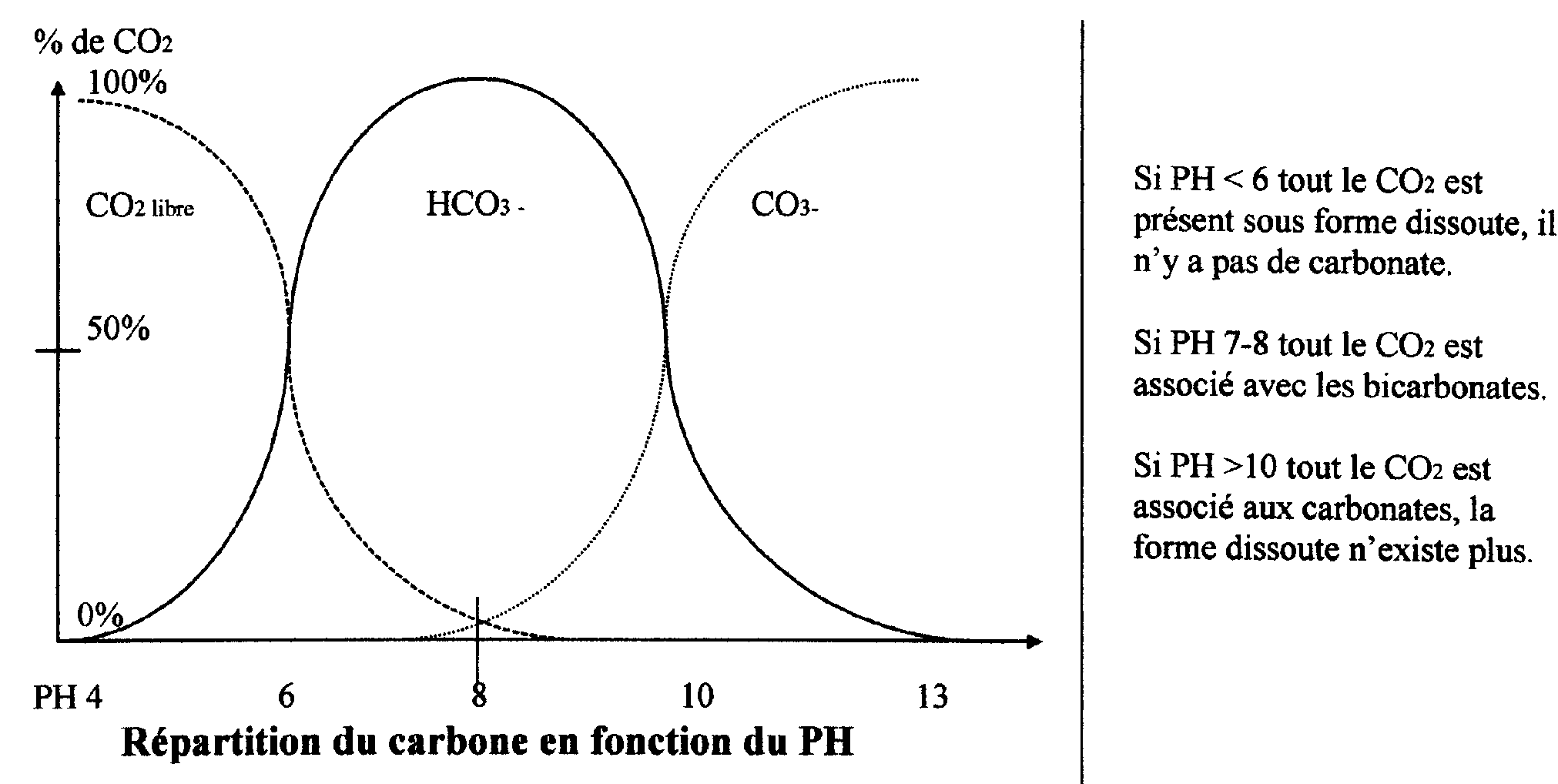
Le dioxyde de carbone (CO2) et le système carbonaté :
Gaz issu de la respiration des êtres vivants, exerce une action sur le T.A.C. et le PH.
C’est un gaz très soluble ~50 X plus que l’oxygène.
Lorsqu’il se dissout dans l’eau, il forme de l’acide carbonique (0,2%).
H2CO3
puis des bicarbonates et des carbonates (calcium, magnésium)
CO2 + H2O => H2CO3- + HCO3- + H+
gaz carbonique +eau => acide carbonique + bicarbonate + acide (hydrogène)
Cette réaction fait baisser le PH.
Le T.A.C. d’une eau varie avec la concentration en CO2 jusqu’à équilibre.
L’équilibre :
( bicarbonates) déficit CO2 (carbonate )
Ca ( HCO3)2 => CaCO3 + CO2 + H2O
excès CO2 Précipité
on a donc PH dépend de CO2 libre
CO2 des bicarbonates
III) Aspects biologiques :
1) L’action des bactéries :
Tout être vivant génère des matières organiques issues de son métabolisme. Les matières organiques dissoutes dans l’eau vont subir plusieurs transformations sous l’action des bactéries aérobies (qui respirent l’oxygène). Le principal élément de dégradation est l’azote " N "(~~16% de la plupart des protéines). La première molécule entrant en jeu est l’ammonium/ammoniac NH4+/NH3 qui provient de l’ammonification des protéines transformées en ammonium / ammoniac par des bactéries (clostridium, flavobactéries, pseudomonas, etc...).Protéines, acides aminés, azote ammoniacal, ammonium+ammoniac.
Les molécules azotées s’accumulent dans le milieu fermé qu’est l’aquarium et ont des toxicités différentes.
Ammoniac NH3 0,1mg/l
Ammonium NH4+ 1mg/l
Nitrites NO2 - 0,5mg/l seuil de letalite
Nitrates NO3 - 50mg/l (invertébrés)
500mg/l (poissons)
L’ammoniac va être transformé en nitrites NO2 -lors de la " nitrosation "2NH4+ + 3O2 + => 2NO2- +4H++2H2O par les bactéries " nitrosomas ", cette molécule NO2 - est ensuite transformée en nitrates NO3 - lors de la " nitration " 2NO2 -+O2 => 2NO3 -
par les bactéries " nitrobacter ". Globalement on a :
2NH4++4O2 => NO3-+H2O+H+ .C’est une réaction gourmande en oxygène ; c’est la "nitrification " 2 mg d’O2 pour 1 mg de matière organique...
Si dans cette dernière équation on fait intervenir la matière organique on a :
Matière organique + oxygène => nitrates +eau+acide+gaz carbonique
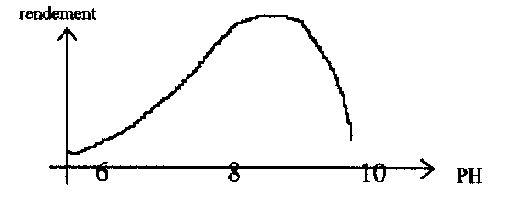
On constate une libération d’acide, d’où l’importance d’avoir un TAC > 0, de plus ces transformations ne s’opèrent correctement que si PH > 7
Le PH influence également la teneur en ammonium/ammoniac.

Plus le PH est bas plus la teneur en ammoniac est faible. Les variations de PH entraînent donc des variations en concentration de l’ammoniac qui peuvent être fatales.
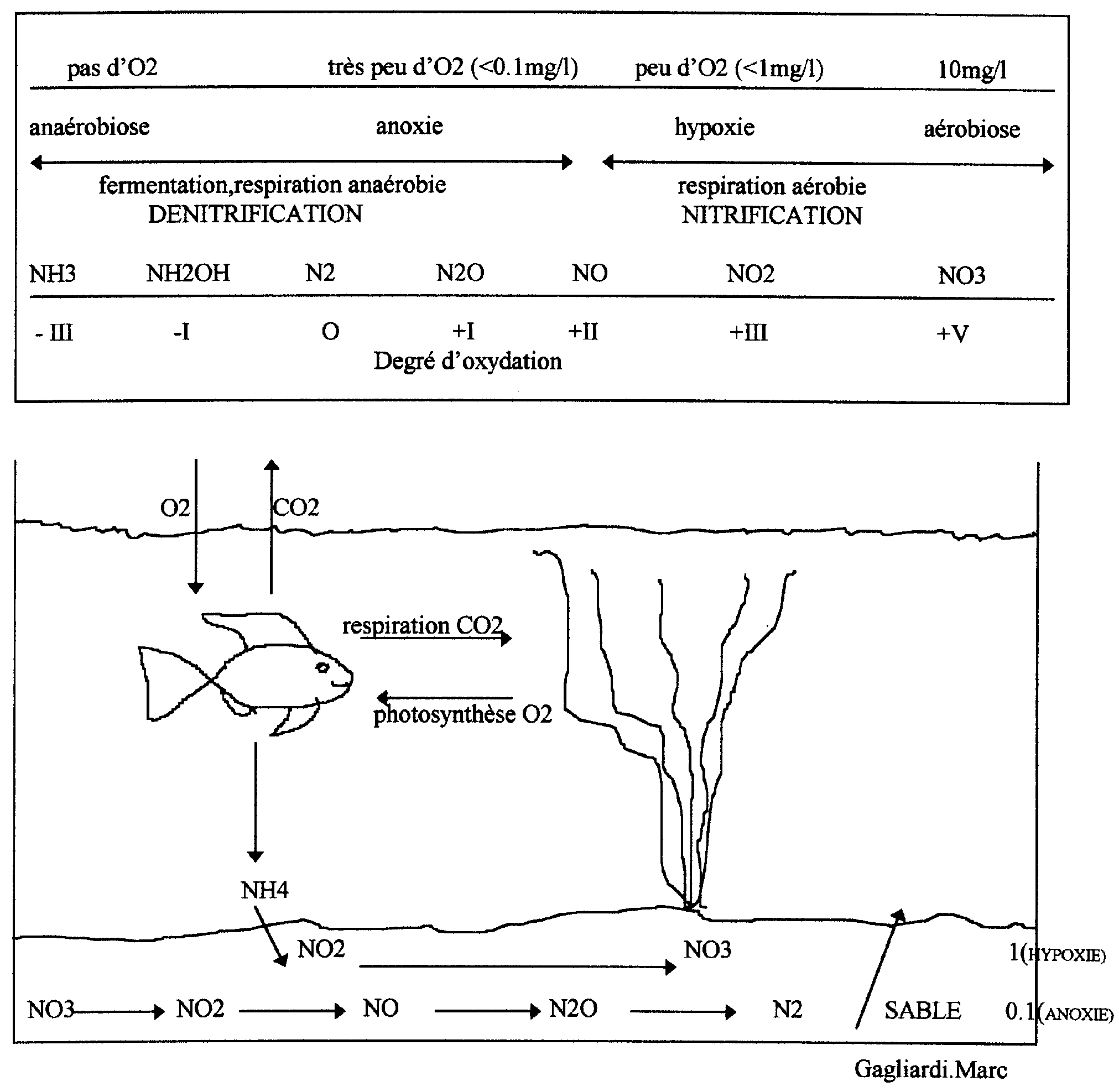
2) Evolution en fonction de l’oxygène :
Dans le détail, on constate que la Nitrification est réversible, c’est-à-dire que les nitrates peuvent être transformés en azote (c’est la dénitrification). Le point qui dicte l’ordre de ces transformations est le pouvoir oxydant de l’eau (son potentiel redox), suivant la concentration en oxygène de l’eau on a :
IV) Pilotage des paramètres et des produits de dégradation :
1) Les paramètres :
a) Clé de calcul de dureté à partir de données indiquées sur les eaux minérales.
Les concentrations sont exprimées en mg/l. Il convient de les multiplier par un coefficient pour avoir des degrés.
Pour le calcium (Ca) 0,25
Pour le magnésium (Mg) 0,41
Pour les bicarbonates (HCO3-) 0,082
et le TH = Cax 0,25 = Mg x 0,41
le TAC = HCO3- X 0,082
Si les concentrations sont en milliequivalent me/l, il suffit de multiplier par 5 pour obtenir des degrés.
Exemple :
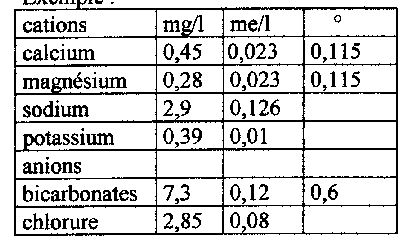
On a donc TAC = 0,6°
TH = 0,23°
b) Les mélanges : Recherche de dureté.
Pour obtenir une eau avec des valeurs souhaitées, différentes de celles de l’eau de conduite. Il convient de mélanger des types différents.
Deux méthodes de calcul sont à votre disposition
1) Algébrique :
on a 1ere eau : Volume = V1
TH = C1
2eme eau : Volume = V2
TH = C2
mélange : Volume = V
TH = C
V1 =V.(C-C2)
C1-C2
V2 = V.(C1-C) C
C1-C2
ex : on veut préparer une eau à 10° F
un volume de 20 litres V
C1
en mélangeant une eau à 30° F et une eau à 5° F C2
V1 = 20 x (10- 5) = 100 = 4 litres
(30 - 5) 25
V2 = 20 x (30 - 10) =400=16 litres
(30 - 5 ) 25
2) Arithmétique
croix des constituants
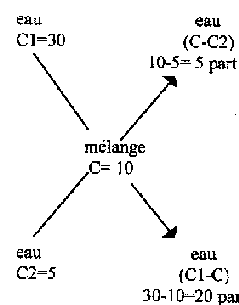
-on fait la somme des parts
S=5+20=25
-on calcul le coefficient
K=volume(V)=20=0.8
S 25
-on calcule les volumes
V1=5 x K(0.8)=4 litres
nb de parts
V2=20 x K(0.8)=16 litres
3) Lorsqu’on mélange deux volumes connus on a la formule suivante qui donne le TH du mélange:
C=(V1 x C1 + V2 x C2)
V
4) Dans les cas plus rares où il est souhaité d’augmenter la dureté par exemple dans le lac Tanganyika, il faudra ajouter des éléments à l’eau, soit : pour 100 litres d’eau:
-hydroxycarbonates de magnésium :14,4 g
-hydrogénocarbonates de sodium : 12,5 g
-chlorure de potassium : 5,9 g
l’eau ainsi obtenue titre :
TH ~ 20
TAC ~ 32,4
On peut aussi rajouter de l’eau de mer à concurrence d'1 à 2 %
c) LE PH :
On a vu que le PH était intimement lié à l’alcalinité de l’eau (TAC) et à la concentration en gaz carbonique.
C’est donc sur ces deux paramètres que l’on doit agir, cependant il faut compter avec les acides organiques produits par la nitrification et avec les acides humiques présents dans l’eau soit volontairement (tourbe ajoutée) soit involontairement (présence de végétaux en décomposition).
A l’heure actuelle les acides organiques ne posent pas de problème, les aquariophiles effectuant des changements d’eau réguliers.
Les acides humiques apportés par la tourbe sont des acides très faibles, c’est-à-dire que leur action ne se fait sentir, que pour des valeurs du TAC très faibles à partir de 5°F.
L’abaissement du PH par la tourbe est donc réel uniquement lors de l’emploi d’eau douce à très douce. Outre cet effet bien d’autres éléments sont libérés par la tourbe, éléments qui en petites quantités contribuent à l’équilibre biologique de l’aquarium (oligo- éléments,tanin).
L’abaissement du PH par l’augmentation du taux de gaz carbonique dissous est une solution alternative intéressante car elle va permettre également d’assurer la croissance des plantes optimales.
Les différentes solutions pour maintenir un taux de gaz carbonique adéquate passe par plusieurs actions :
-éviter l’aération de l’eau trop violemment
-mettre des couvercles sur l’aquarium
-effectuer des rajouts de CO2
-abaisser le TAC de l’eau
Pour les eaux d’alcalinité moyenne à forte le taux de gaz carbonique libre est très faible d’où un PH élevé ( et en corollaire ,une mauvaise croissance des plantes). L’addition de CO2 dosé de façon à rentrer dans une fourchette optimale va abaisser le PH et favoriser les plantes.

D’autre part, il faut noter que les plantes en l’absence de CO2 dissous vont détruire les bicarbonates HCO3- pour en récupérer le CO2, c’est la décalcification biogène, le TAC va donc s’abaisser et l’eau devenir instable et dangereuse (sans intervention régulière de la part de l’aquariophile).
2) Les produits de dégradations
Les produits de dégradations des matières organiques vont s’accumuler.Les nitrates, (élément majoritaire) à taux élevé entraînent des baisses de longévité et des retards de croissance des poissons. Le premier moyen de lutte est le changement d’eau.
a) Calcul d’un volume d’eau à changer :
Pour une population et un nourrissage constant, on peut appliquer la méthode suivante :
-calcul de la production NO3:
N(actuel) - N(précédent) = N/j
nb de jours séparant les prises d’échantillons
-soit (N) max la valeur que l’on ne veut pas dépasser :
(N)max = 100 x (N)/jour x D
% C
D = nombre de jours entre 2 renouvellements
% C = pourcentage d’eau renouvelée
Calcul de nombre de jours D :
D = (N)max x % C
(N)/jour x 100
Calcul de pourcentage d’eau :
% C = 100(N)jour xD
(N)max
exemple :
On veut maintenir un taux de 20mg/l NO3, on choisit de faire 1 renouvellement d’eau de 25% . On a mesuré la valeur NO3 = 10mgl aujourd’hui. Dix jours jours après NO3 = 11 mgl
On a : (N) jour = 11-10 = 1 = 0,1
10 10
D = 10x 25 = 250 = 25 jours
0,1x100 10
Il faudrait renouveler 25% d’eau tous les 25 jours.
b) Dénitratation :
La dénitratation consiste à favoriser la digestion des nitrates par des bactéries anoxique, ce sujet étant à lui seul un article, nous le traiterons prochainement.
c) Action sur le cycle de l’azote :
Lorsque l’on regarde le cycle de l’azote ci-dessous on constate que l’élimination des produits de dégradations des protéines, passe par des actions sur le cycle de l’azote à plusieurs niveaux.
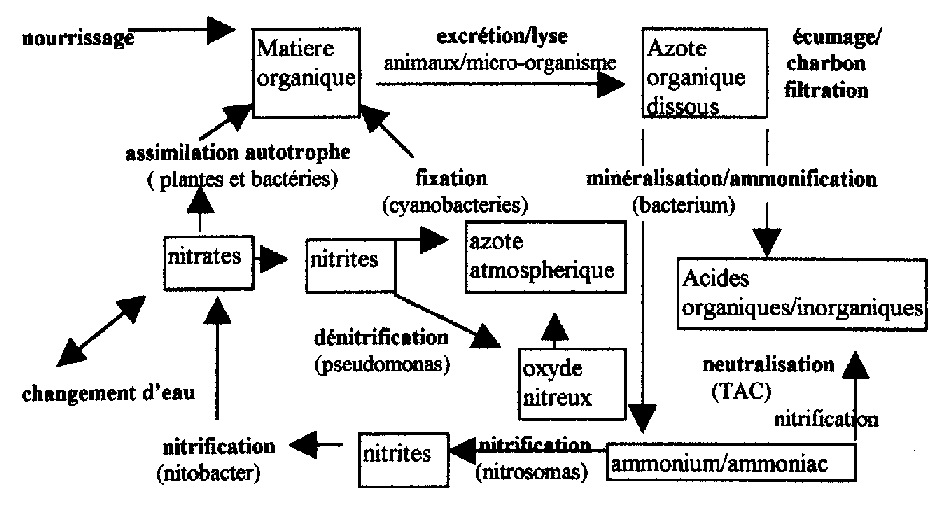 Ainsi, les actions d’élimination
en fin de cycle des nitrates et des phosphates conduisent à l’emploi de
plusieurs méthodes
Ainsi, les actions d’élimination
en fin de cycle des nitrates et des phosphates conduisent à l’emploi de
plusieurs méthodes
-l’élimination à l’aide de résine échangeuse d’ions, donne de bons résultats mais, en utilisation à long terme cela entraîne des déséquilibres de l’eau.
-l’élimination par dénitrateur, matériel efficace s’il est bien piloté, mais relativement onéreux (en cas d’automatisation).
-l’élimination après absorption par les algues et plantes supérieures, méthode plus naturelle, puisqu’elle consiste à transformer son aquarium en un jardin où les élagages sont autant de produits azotés enlevés.
-la digestion à son degré le plus poussé par l’emploi de techniques telle que l’aquarium récifal type Berlin pour les aquariums d’eau de mer.
On peut également agir en début de cycle c’est-à-dire avant la transformation des matières organiques en éléments minéraux :
-le changement d’eau est un moyen efficace mais difficile à mettre en oeuvre dans la plupart des cas.
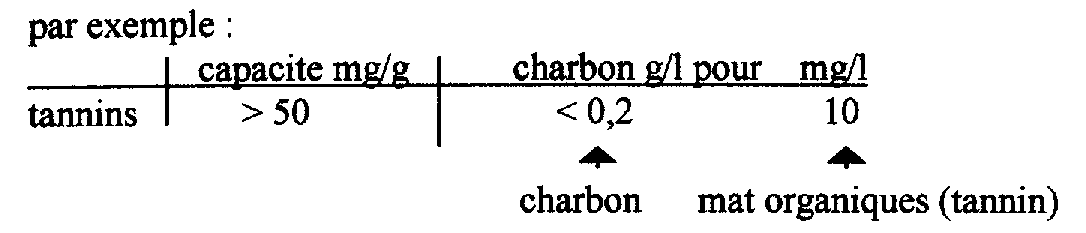
-le charbon actif est une réponse intéressante, son pouvoir d’absorption est très important vis-à-vis des matières organiques. Il permet une forte épuration pour une quantité relativement faible
Il permet également d’éliminer les métaux et le chlore.
Mais il ne faut pas oublier que la pollution est déplacée, pas éliminée, le charbon est un piège. Il faut penser à changer le charbon dés saturation.
-L’ECUMAGE possible uniquement en eau de mer ou saumâtre joue le rôle d’épurateur des matières organiques, par concentration dans l’écume des déchets azotés et des carbohydrates avant leurs transformations.
Enfin un facteur important de pollution est la population de l’aquarium, qui ne doit pas être trop importante et respecter certaines règles :
Un facteur moins connu est le choix de la population ainsi certains poissons polluent plus que d’autres, et surtout, la copie perfectible de la nature qu’est l’aquarium passe par une population en harmonie.
Par là, j’entends, un choix de peuplement permettant de créer une chaîne alimentaire la plus complexe possible et qui pourra participer activement à la transformation au stade le plus ultime de tous les déchets produits.